Опыт применения в терапии псориаза
В статье представлен российский опыт использования и результаты лечения секукинумабом пациента с распространенным вульгарным псориазом и псориазом ногтей.

Псориаз является хроническим рецидивирующим воспалительным заболеванием, которым страдают около 125 млн человек по всему миру [1]. В Российской Федерации заболеваемость псориазом составляет 65,8 на 100 тыс. населения, причем отмечается большой удельный вес тяжелых и среднетяжелых форм в структуре заболеваемости [2]. В последние годы заболевание рассматривается как системный процесс, который поражает не только кожу, но и другие производные соединительной ткани (суставы, энтезисы).
Почему же при псориазе, особенно при его тяжелых формах, мы все чаще обращаем внимание именно на ногти? Ногти считаются эпидермальным придатком и действительно чаще всего поражаются у больных псориазом. Поражение опорно-двигательного аппарата при псориазе начинается в первую очередь с вовлечения в патологический процесс энтезисов, которыми изобилуют ногти. Часто этот процесс происходит незаметно. Сегодня ногти рассматриваются в качестве видимой части энтезисов (рис. 1, адаптировано из [3]). В итоге поражение ногтей при псориазе является четким предиктором дальнейшего развития псориатического артрита.
![Рис. 1. Анатомические связи ногтя и дистального межфалангового экстензорного тензора (адаптировано из [3]) Рис. 1. Анатомические связи ногтя и дистального межфалангового экстензорного тензора (адаптировано из [3])](https://www.rmj.ru/upload/medialibrary/a55/60-1.png)
Псориаз может поражать две структуры ногтей — матрикс и ногтевое ложе. Поражение матрикса ногтя может привести к таким изменениям, как лейконихия, симптом наперстка, разрушение ногтевой пластины. Вовлечение же ногтевого ложа в патологический процесс может привести к онихолизису, подногтевому гиперкератозу и кровоизлияниям. Поражения ногтей не только вызывают эстетические и функциональные нарушения, но и свидетельствуют о более тяжелых формах псориаза.
Считается, что поражение ногтей встречается у 80–90% пациентов с псориазом [3]. По другим источникам, распространенность псориаза ногтей составляет около 50% [4–6]. Исследования, проведенные в Германии в 2010 г. с участием 3531 больного псориазом, установили, что псориаз ногтей в большей степени распространен среди пациентов мужского пола (11,2%) [7]. Есть данные, что среди пациентов с псориатическим артритом распространенность поражения ногтей составляет 80,5% [7, 8]. При этом у 15% пациентов изменения ногтей могут наблюдаться при отсутствии кожных поражений [8–10].
Несмотря на свои эстетические и функциональные последствия, псориаз ногтей мало рассмотрен в литературе. Кроме того, по данной теме проведено лишь несколько эпидемиологических и клинических исследований.
Лечение псориаза
Терапия среднетяжелого и тяжелого псориаза с помощью метотрексата, циклоспорина, ароматических ретиноидов, фототерапии не всегда позволяет контролировать течение как самого дерматоза, так и поражения ногтей.
Системная терапия рекомендуется при сочетанном поражении кожи и ногтей. Несмотря на то что эффективность метотрексата в лечении кожного псориаза была описана в многочисленных исследованиях, а его применение у пациентов с псориазом ногтей малоизучено, Европейский консенсус по лечению псориаза ногтей при тяжелых формах болезни рекомендует комбинацию метотрексата с топической терапией [11, 12]. Активное изучение влияния генно-инженерной биологической терапии (ГИБТ) на течение псориаза и псориатического артрита началось после того, как было доказано, что псориаз и псориатический артрит являются Т-клеточно опосредованными заболеваниями, при которых происходит активация клеточного иммунитета в коже и синовии с гиперпродукцией и дисбалансом противо- и провоспалительных цитокинов. После получения вдохновляющих данных по эффективности ГИБТ стало понятно, что появился реальный шанс помочь пациентам с этим тяжелым недугом.
Инфликсимаб — первый хорошо изученный иммунобиологический агент. Исследования доказали его эффективность как при псориазе гладкой кожи, так и при псориазе ногтей [13, 14]. Адалимумаб, этанерцепт, устекинумаб также оказались эффективными средствами в лечении пациентов с псориазом кожи и ногтей [15–17]. Важно отметить что все исследования были проведены в когорте пациентов с комбинированным поражением ногтей и кожи.
В 2016 г. в России зарегистрирован препарат, относящийся к группе ингибиторов интерлейкина-17 А (IL-17 А) —
секукинумаб [18]. Секукинумаб (Козэнтикс, Новартис Фарма АГ, Швейцария) — препарат для лечения псориаза среднетяжелой и тяжелой степени у взрослых пациентов, которым показана системная терапия или фототерапия, представляет собой полностью человеческое моноклональное антитело к человеческому иммуноглобулину G1κ (IgG1κ) и обладает селективным действием в отношении IL-17А.
В результате исследований выявлено, что IL-17А является ключевым цитокином, определяющим патогенез псориаза, и действует непосредственно на кератиноциты, стимулируя секрецию провоспалительных медиаторов [19, 20].
В настоящее время относительно безопасности, эффективности и влияния терапии секукинумабом на качество жизни пациентов с псориазом различных локализаций (в т. ч. устойчивым к стандартным методам лечения и проблемной локализации — ладонно-подошвенным псориазом, псориазом волосистой части головы, псориатической ониходистрофией) и псориатическим артритом опубликованы результаты 11 масштабных прямых сравнительных клинических исследований (4 — II фазы, 7 — III фазы). Наиболее крупными из них были FIXTURE (n=1306), SCUPLTURE (n=965), ERASURE (n=738), CLEAR (n=669), TRANSFIGURE (n=198), SCALP (n=102), FEATURE (n=177), JUNCTURE (n=182), GESTURE (n=205) и др. [21–28].
Следует отметить, что результаты всех исследований показали очень высокую скорость регресса кожных проявлений, что является несомненным преимуществом препарата [29]. По результатам двойных слепых плацебо-контролируемых исследований, в которых проводилось сравнение секукинумаба с этанерцептом и устекинумабом, секукинумаб показал доказанно лучшие результаты по эффективности влияния на состояние кожи, улучшению качества жизни как в кратковременной, так и в длительной перспективе, а также благоприятный сопоставимый профиль безопасности [30, 31]. Согласно PASI 90 (Psoriasis Area and Severity Index — индекс распространенности и тяжести псориаза), уже на 16-й неделе наблюдения секукинумаб показал эффективность на 20% выше по сравнению с устекинумабом [21]. Кроме того, в клинических исследованиях получены неоспоримые доказательства эффективности секукинумаба при псориазе ногтей, волосистой части головы, а также ладонно-подошвенном и пустулезном псориазе. С точки зрения форм псориаза, плохо поддающихся лечению, таких как ладонно-подошвенный, псориаз ногтей и др., новые инновационные средства представляют особый интерес. Результаты исследования TRANSFIGURE [21], в котором изучалась эффективность секукинумаба при псориазе ногтей, ярко демонстрирует прекрасные результаты лечения. Пациенты, включенные в это исследование, более 10 лет страдали от псориаза ногтей. Фото пациента, представленные в статье, наглядно демонстрируют новые возможности терапии псориаза ногтей (рис. 2а, б, в). Особенно важно отметить, что результаты терапии появлялись в короткие сроки.
![Рис. 2. Результаты терапии псориаза ногтей секукинумабом (из [3]): а – до лечения (PASI: 15.00; NAPSI: 38; ppIGA: 0); б – 16-я неделя лечения (PASI: 15.60; NAPSI: 74; ppIGA: 4); в – 80-я неделя лечения (PASI: 0; NAPSI: 4; ppIGA: 0) Рис. 2. Результаты терапии псориаза ногтей секукинумабом (из [3]): а – до лечения (PASI: 15.00; NAPSI: 38; ppIGA: 0); б – 16-я неделя лечения (PASI: 15.60; NAPSI: 74; ppIGA: 4); в – 80-я неделя лечения (PASI: 0; NAPSI: 4; ppIGA: 0)](https://www.rmj.ru/upload/medialibrary/241/60-2.png)
Приводим пример клинической эффективности и переносимости терапии препаратом секукинумаб (Козэнтикс) в лечении пациента с вульгарным псориазом и псориазом ногтевых пластин.
Клиническое наблюдение
Пациент М., 38 лет, был направлен с диагнозом: вульгарный псориаз, распространенная форма, прогрессивная стадия. Псориаз ногтевых пластин.
Впервые обратился в 2014 г. с жалобами на высыпания на коже туловища (грудь, спина, живот), верхних и нижних конечностей, умеренный зуд в течение дня. Считает себя больным в течение 10 лет, когда впервые заметил бляшечные элементы в области разгибательных поверхностей верхних конечностей. Пациент неоднократно получал амбулаторное лечение наружными гклюкокортикостероидами совместно с физиотерапией с временным эффектом. С 2016 г. получал препарат метотрексат, начальная дозировка 25 мг/нед., совместно с фолиевой кислотой, при стабильном эффекте доза была снижена до 17,5 мг/нед.
На данной терапии был стабильный положительный эффект в течение года. С 2017 г. произошло ухудшение кожного процесса, возникла болезненность мелких суставов. В связи с резистентностью к данному виду терапии консилиум принял решение о применении ГИБП.
Хронические заболевания: хронический холецистит, ремиссия. Хронический тонзиллит, К-форма, стадия ремиссии, хронический ринофарингит, неполная ремиссия.
Заключение терапевта (от 02.11.2017): терапевтически здоров. На момент осмотра, лечение секукинумабом (Козэнтикс) не противопоказано.
С ноября 2017 г. начато этапное лечение секукинумабом. Перед началом терапии пациент прошел стандартные обследования для выявления возможных противопоказаний к применению ГИБП: обследования на ВИЧ, гепатиты В, С, туберкулез (рентгенография органов грудной клетки, консультация фтизиатра), исключение онкологического процесса, клинические анализы крови и мочи, биохимическое исследование крови (уровень глюкозы, аланинаминотрансферазы — АЛТ, аспартатаминотрансферазы — АСТ, гамма-глутамилтрансферазы, креатинина, С-реактивного белка, липидный профиль). При обследовании исключены туберкулез и другие инфекционные заболевания, данных за онкологические заболевания не выявлено. До начала лечения в клиническом анализе крови отклонений от нормы не выявлено, в биохимическом анализе крови: билирубин общий — 10,3 мкмоль/л; АЛТ — 22,1 Ед/л; АСТ — 19,5 Ед/л; щелочная фосфатаза — 125 Ед/л; холестерин — 4,16 ммоль/л; глюкоза — 7,75 ммоль/л; креатинин — 63,6 мкмоль/л; мочевина — 5,45 ммоль/л; общий белок — 72,5 г/л.
Препарат секукинумаб назначен в дозе 300 мг согласно инструкции по применению препарата в виде подкожных инъекций. Инициирующий курс составил 4 еженедельные инъекции. В дальнейшем терапия продолжена в виде ежемесячных инъекций.
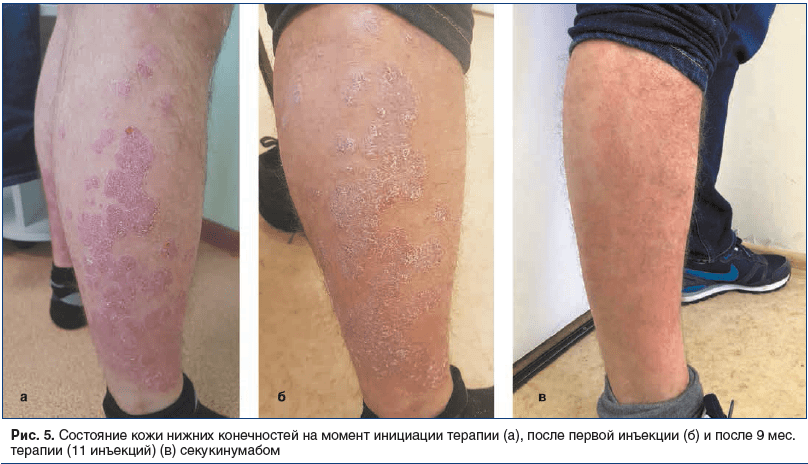
Status localis на момент начала терапии: на коже волосистой части головы (височные, затылочная область), туловища (грудь, спина, живот), верхних конечностей (разгибательные поверхности предплечий, локтевых суставов), нижних конечностей (передние и задние поверхности бедер, голеней, разгибательные поверхности коленных суставов) — множественные, инфильтрированные по периферии бляшки розового цвета, покрытые частично прилегающими серебристыми чешуйками на поверхности. Триада Ауспитца положительная. Вокруг элементов венчик Пильнова. На ногтевых пластинах кистей определяются симптомы наперстка и масляного пятна (рис. 3а, 4а и 5а). Деформация суставов, отечность не определялись.
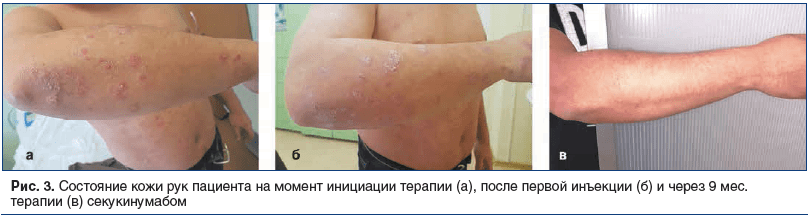


Результаты терапии. На фоне начала терапии уже в течение 7 дней после первой проведенной инъекции секукинумаба отмечена положительная динамика (рис. 3б, 5б). После проведения 4-недельного инициирующего курса отмечен практически полный регресс высыпаний. На коже туловища и конечностей не было появления новых элементов, зуд был полностью купирован, оставались множественные пятна поствоспалительной гиперпигментации в местах бывших высыпаний, незначительное шелушение на поверхности неплотно прилегающими чешуе-корками. Уже через 8 нед. от начала терапии секукинумабом отмечалась зона отрастания неизмененных ногтевых пластин примерно на 0,5 см.
После 6 инъекций на коже туловища (грудь, спина, живот), верхних конечностей (разгибательные поверхности предплечий, локтевых суставов), нижних конечностей (передние и задние поверхности бедер, голеней, разгибательные поверхности коленных суставов) оставались только пятна поствоспалительной пигментации, чешуе-корок нет.
После 9 инъекций наступил полный регресс клинической картины (кожа чистая, ногтевые пластины чистые; симптомы масляного пятна и наперстка отсутствуют).
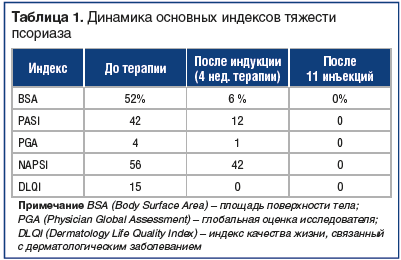
В настоящее время (после 11 инъекций) сохраняется полная ремиссия. Ногтевые пластины без патологических изменений, кожные покровы без высыпаний и шелушений, пигментные пятна полностью разрешились (рис. 3в, 4б, 5в). Динамика всех показателей менялась в короткие сроки от начала терапии. Данные показателей представлены подробно в таблице 1.
Влияние на качество жизни. Следует отметить, что до лечения индекс DLQI (Dermatology Life Quality Index) составлял 15 баллов, что отражает очень сильное влияние кожного заболевания на качество жизни пациента. После первой инъекции данный показатель составил 15 баллов, после второй — 11 баллов, после третьей — 10 баллов, после четвертой — 0 баллов. То есть заболевание перестало негативно воздействовать на повседневную жизнь пациента.
Курс лечения секукинумабом составил 9 мес. и будет продолжен.
Лабораторный контроль в течение первого месяца терапии проводился 1 раз в 7 дней, далее 1 р./мес. В клиническом анализе крови отклонений не выявлено. Результаты биохимического анализа крови и клинического анализа мочи — без отрицательной динамики, показатели стабильны.
Заключение
Представленное наблюдение демонстрирует высокую клиническую эффективность препарата Козэнтикс (секукинумаб) в терапии пациента с вульгарным псориазом и псориазом ногтей. Достигнута быстрая и сохраняется стабильная нормализация всех показателей: PASI, ВSA, PGA и DLQI.
Лечение переносится хорошо, нежелательных явлений в течение терапии не выявлено.
Можно сделать вывод, что препарат полностью контролирует заболевание и улучшает качество жизни пациентов с псориазом ногтей.
Таким образом, на сегодняшний день есть уверенность в том, что можно контролировать развитие таких тяжелокурабельных форм псориаза, как псориаз ногтей, прогрессирование которого является определенным предиктором развития псориатического артрита и инвалидизации. Раннее начало применения ГИБП позволит вовремя предупредить развитие псориатического артрита.
Источник
Псориаз— аутоиммунное заболевание мультифакториального генеза срецидивирующим течением, многообразием фенотипов, клинических разновидностей ивозможным выявлением различных коморбидностей [1–4]. Поданным литературы, распространенность псориаза вовсем мире составляет 4–7% [5].
По мнению K. Reich, легкие формы заболевания, которые поражают менее 3–5% площади тела и не дают значимых изменений в иммунном статусе больного, требуют только местного лечения. Псориаз среднетяжелого и тяжелого течения является системным, иммуноопосредованным воспалительным процессом, приводящим к развитию сопутствующих патологий или усугубляющим их, а они сами по себе оказывают огромное влияние на здоровье и качество жизни пациента [6–9].
Проблема лечения псориаза не теряет своей актуальности и, несмотря на появление новых современных методов лечения, остается сложной задачей, требующей персонифицированного и, в случае выявления тяжелых коморбидностей, — мультидисциплинарного подхода [10].
Для лечения псориаза существует широкий выбор местных и системных препаратов, большинство из которых обладают иммуномодулирующим эффектом. При выборе персонифицированной терапии учитывается распространенность и степень тяжести псориаза, стадия псориатического процесса, его клиническая форма, а также отношение к болезни самого пациента. Так, при локализации высыпаний на открытых участках кожного покрова — лицо, волосистая часть головы и кисти, болезнь оказывает значительное влияние на качество жизни и вызывает тяжелые психоэмоциональные переживания [11]. По данным исследования G. Krueger и соавт. (2001), 40% больных псориазом были разочарованы неэффективностью получаемого лечения и 32% считали лечение недостаточным [12].
Системная терапия псориаза
Системные глюкокортикоиды в таблетированной форме применяются крайне редко в связи с многочисленными побочными эффектами. Однако в качестве препарата «скорой помощи» для стабилизации псориатического процесса при прогрессирующей стадии, эритродермии целесообразно использование пролонгированных системных глюкокортикоидов для внутримышечного введения в виде коротких курсов. Подобный подход к терапии позволяет избежать неблагоприятных побочных эффектов [2].
Более 40 лет при лечении псориаза применяется метотрексат. Механизм его действия связан с ингибированием дигидрофолатредуктазы, превращающей дигидрофолиевую кислоту в тетрагидрофолиевую и являющейся донором одноуглеродных групп в синтезе пуриновых нуклеотидов и тимидилата, необходимых для синтеза ДНК. В связи с этим одновременное назначение фолиевой кислоты помогает избежать метаболической анемии [13].
Циклоспорин, А — циклический полипептид, выделенный из гриба Tolypocladium inflatum gams, обладает иммуносупрессивным действием посредством подавления активности Т-клеток и снижения их антигенной чувствительности за счет интерлейкинового механизма. Препарат обладает высокой эффективностью при лечении распространенного торпидно протекающего псориаза, псориатической эритродермии [14, 15].
С 1997 г. для лечения рефрактерных форм псориаза используются ароматические ретиноиды второго поколения, основой химической формулы которых является ацитретин. Препарат тормозит пролиферацию клеток эпидермиса, нормализует процесс ороговения, оказывает иммуномодулирующее действие. Эффективность средства зависит от дозы: более высокие дозы приводят к более быстрому разрешению псориатических высыпаний [16].
Относительно недавно появилась новая группа препаратов — биологические препараты, к которым относят рекомбинантные белковые субстанции, синтезированные биотехнологическим путем из живых клеток животных, растений и микроорганизмов. Показанием к назначению биологических препаратов являются тяжелые формы псориаза, резистентные к другим системным препаратам [17, 18].
Лечение среднетяжелых и тяжелых форм псориаза (более 10% поверхности тела) проводят с учетом коморбидных состояний, таких как метаболический синдром, сердечно-сосудистые заболевания, сахарный диабет, неалкогольная жировая болезнь печени, дислипидемия. По данным статистических исследований, подобные коморбидные состояния при псориазе наблюдаются чаще, чем в общей популяции [19]. Таким образом, при лечении псориаза необходимо учитывать риск побочных эффектов от проводимой системной терапии соответственно коморбидным состояниям, выявляемым индивидуально у каждого больного. Действительно, некоторые фармакологические препараты могут негативно повлиять на сердечно-сосудистые и метаболические сопутствующие заболевания. Связь между псориазом и сердечно-метаболическими расстройствами имеет важные клинические последствия. Во-первых, системная терапия псориаза может негативно повлиять на обменные сопутствующие заболевания, особенно в случае непрерывного и длительного лечения. В частности, метотрексат следует назначать с осторожностью при ожирении, сахарном диабете, неалкогольной жировой болезни печени в связи с повышением риска фиброза печени [20]. Циклоспорин, А может вызывать появление или усугубить течение артериальной гипертензии, усиливать инсулинорезистентность и влиять на метаболизм жирных кислот, обладает нефротоксичностью.
Ацитретин также способствует гипертриглицеридемии и/или гиперхолестеринемии [21]. Таким образом, при ведении больных с псориазом необходимо учитывать все данные.
Особое место в лечении псориаза отводится фототерапии. Положительный эффект ультрафиолета на псориатическую кожу связан с избирательным угнетением Т-клеточного звена иммунитета. По данным литературы, выделяют следующие направления действия фототерапии: противовоспалительное, иммуносупрессивное и антипролиферативное [22]. Фотоиммунологическое воздействие связано с глубиной проникновения ультрафиолетовых лучей. УФБ-лучи воздействуют на эпидермальные кератиноциты и клетки Лангерганса, УФА-лучи проникают в более глубокие слои кожи и оказывают действие на дермальные фибробласты, дендритные клетки и клетки иммунной системы. Положительный эффект ультрафиолетового излучения обусловлен апоптозом Т-клеток, снижением количества клеток Лангерганса, изменением продукции цитокинов, факторов роста (EGF, VEGF), молекул адгезии и нейропептидов [2, 23]. Назначение фототерапии целесообразно при распространенном кожном процессе.
При лечении псориаза используется фотохимиотерапия (ПУВА-терапия) — сочетанное применение длинноволновых ультрафиолетовых лучей (УФА) (320–400 нм) и фотосенсибилизатора (8-метоксипсоралена). ПУВА-терапия является одним из наиболее эффективных методов лечения псориаза, ее назначение целесообразно при распространенном вульгарном и экссудативном псориазе, упорном течении заболевания, выраженной инфильтрации. Лечение проводится по методике 3- или 4-разового облучения в неделю, в среднем курс составляет 20–30 процедур [22].
В настоящее время селективная фототерапия, комбинация средневолнового излучения (280–320 нм) уступила свои позиции и назначается все реже для лечения псориаза. Показанием для ее назначения является псориаз, характеризующийся слабоинфильтрированными бляшками.
Узковолновая УФБ-терапия с пиком эмиссии на длине волны 311 нм по высокой терапевтической эффективности сравнима с ПУВА-терапией, но в отличие от нее не требует применения фотосенсибилизатора. Проводится по методике 3-5-разового облучения в неделю курсом 20–30 процедур.
Для лечения ограниченного бляшечного псориаза в стационарной стадии высокоэффективной терапевтической методикой является эксимерный лазер, который позволяет доставлять монохроматический свет высокой интенсивности длиной волны 308 нм только на пораженный участок кожного покрова [2, 22, 23].
Местная терапия
Достаточно большой выбор местных средств для лечения псориаза включает, в частности, традиционные мази, содержащие деготь, нафталан, ихтиол и салициловую кислоту.
При выборе топической терапии важен индивидуальный подход, от которого будет зависеть комплаентность больного псориазом. Так, в связи с косметической неприемлемостью лечения 40% пациентов не соблюдают режим назначения [24].
Эффективность топических кортикостероидных препаратов при лечении псориаза основана на выраженном противовоспалительном и иммуномодулирующем действии, связанном с механизмом гормонорецепторного комплекса, который проникает в ядро клетки мишени кожи и увеличивает экспрессию генов, кодирующих синтез пептидов, ингибирующих активность фосфолипазы. Этот механизм приводит к снижению образования медиаторов воспаления из фосфолипидов. Особенно предпочтительны комбинированные кортикостероидные мази и кремы с салициловой кислотой. Местные кортикостероидные препараты не показаны для длительного непрерывного лечения и предполагают комбинированные и ротационные схемы, т. к. длительное применение может привести к развитию побочных эффектов, таких как атрофия кожи, гипертрихоз, телеангиэктазии, стероидные акне и угнетение функции надпочечников [25].
Синтетические аналоги витамина Д3 хорошо зарекомендовали себя в качестве высокоэффективных антипсориатических средств. Наиболее известен из этой группы кальципотриол. Принцип действия препарата основан на кератопластическом эффекте витамина Д3: он тормозит пролиферацию кератиноцитов и моделирует эпидермальную дифференцировку, а также обладает иммуномодулирующим эффектом, в частности уменьшая экспрессию ИЛ-2 и ИНФ-γ [26]. Кальципотриол обладает кумулятивным действием, в связи с чем терапевтический эффект наблюдается через 1–2 нед. от начала лечения.
В отличие от топических стероидов возможно длительное применение данной группы препаратов. Для достижения максимального терапевтического эффекта возможно комбинированное назначение кальципотриола и топических стероидов.
Действие местных ингибиторов кальциневрина (такролимус и пимекролимус) связано с блокированием сигнальной трансдукции Т-лимфоцитов посредством ингибирования кальциневрина. Наиболее целесообразно назначение этой группы препаратов в случае локализации высыпаний на лице, т. к. они не обладают такими побочными эффектами, как топические стероиды [25].
Значение использования эмольянтов, или смягчающих средств, при лечении псориаза не вызывает сомнений: они смягчают кожу, уменьшают шелушение и сухость, усиливают ее гидратацию, особенно после ультрафиолетового воздействия; способствуют уменьшению зуда. Наибольший эффект достигается при нанесении эмольянтов на влажную кожу после контакта с водой (ванна, душ). Использование эмольянтов в комплексной терапии псориаза снижает общую стоимость лечения в результате достижения стабилизации заболевания и наступления ремиссии за более короткие сроки, что способствует сокращению пребывания больных в стационаре [27].
Таким образом, проблема лечения псориаза сохраняет свою актуальность и остается комплексной задачей, направленной в первую очередь на персонифицированный подход к терапии, от которой будет зависеть комплаентность больного псориазом и проспективное ведение пациентов с учетом коморбидности.
Источник
