Что такое триггерная активность при аритмиях

Каналопатии и триггерная активность. Автоматические суправентрикулярные тахиаритмииВ последние годы некоторые разновидности тахиаритмий были отнесены к генетическим нарушениям в каналах, которые управляют ионными потоками через мембраны клеток сердца. Такие «каналопатии» — аномально функционирующие каналы вследствие врожденных мутаций — могут поразить любую электрически активную клетку и не ограничиваются только сердцем. Так, некоторые виды мигреней, эпилепсии, периодического паралича и заболеваний мышечной ткани, по-видимому, обусловлены каналопатией. Среди аритмий, вызванных каналопатией, наиболее распространенные и в то же время наиболее клинически значимые — те, которые связаны с триггерной активностью. Триггерная активность вызывается аномальными потоками положительных ионов внутрь сердечной клетки. Эти ионные потоки вызывают довольно острый «выступ» на потенциале действия в конце фазы 3 или в начале фазы 4. Этот выступ называется следовой деполяризацией. Полагают, что в большинстве случаев следовая деполяризация обусловлена врожденной патологией каналов, управляющих движением ионов кальция через клеточную мембрану. Если следовые деполяризации достаточно большие, они способны открывать быстрые натриевые каналы (которые, как уже упоминалось, являются потенциалзависимыми), генерируя таким образом следующий потенциал действия. Аритмии, вызванные дигиталисной интоксикацией, «пируэтные» нарушения ритма, и редкие случаи желудочковой тахикардии, отвечающей на блокаторы кальциевых каналов, вероятнее всего обусловлены триггерной активностью. Прежде чем приступить к обсуждению вопроса о том, как «работают» антиаритмические препараты, будет полезно произвести обзор важнейших клинических характеристик основных сердечных тахиаритмий.
Автоматические суправентрикулярные тахиаритмииАвтоматические суправентрикулярные аритмии наблюдаются почти исключительно в острых ситуациях, к которым относятся ишемия миокарда, обострение хронического легочного заболевания, острая алкогольная интоксикация и выраженный электролитный дисбаланс. Любое из этих нарушений способно продуцировать автоматические фокусы в предсердном миокарде. Как и при всех автоматических ритмах, начало и окончание в основном относительно постепенные, то есть в течение нескольких циклов наблюдается «разогрев» (или «охлаждение»), когда сердечный ритм учащается (или урежается). Каждому комплексу QRS предшествует обособленный зубец Р, форма которого обычно отличается от таковой при нормальном синусовом зубце Р и зависит от локализации автоматического фокуса в предсердии. Соответственно, интервал PR нередко короче, чем на синусовом ритме, так как эктопический фокус может находиться относительно близко к АВ-узлу. Поскольку автоматические предсердные тахикардии возникают и локализуются в предсердном миокарде (и поэтому аритмия сама по себе не зависима от АВ-узла), то появление АВ-блокады не оказывает воздействия на предсердную аритмию. Мультифокальная предсердная тахикардия (МФПТ) — наиболее частая форма автоматической предсердной тахикардии. Она характеризуется множественной (не менее трех форм) морфологией зубцов Р и нерегулярными интервалами PR. Полагают, что мультифокальная предсердная тахикардия — это результат наличия в миокарде нескольких автоматических фокусов, работающих с различными частотами. Аритмия в большинстве случаев связана с обострением хронического легочного заболевания, особенно у пациентов, получающих теофиллин. Фармакологическая терапия автоматической предсердной тахикардии, как правило, не очень эффективна, хотя препараты, воздействующие на АВ-узел, иногда способны замедлять желудочковый ритм вследствие развития АВ-блокады II степени. Стратегия лечения автоматических предсердных аритмий заключается в активной терапии основного заболевания. — Также рекомендуем «Реципрокные суправентрикулярные тахиаритмии. АВ-узловая реципрокная тахикардия» Оглавление темы «Проводящая система сердца»: |
Источник
Доминирование синусового узла над латентными водителями ритма
Клетки многих областей сердца в норме способны спонтанно генерировать импульсы. Эти области включают синусовый узел, специализированные волокна предсердий, коронарный синус, АВ-соединение и клапаны, а также специализированную проводящую систему желудочков. Однако при заболевании сердца возникновение импульса может наблюдаться практически везде, даже в рабочем миокарде предсердий и желудочков. Клетка (или небольшая группа клеток) становится водителем ритма сердца в том случае, если она первой деполяризуется до порогового уровня и вызывает появление импульса, который обязательно проводится по всему сердцу и возбуждает другие потенциальные водители ритма, прежде чем они смогут спонтанно деполяризоваться до порогового уровня.
Место инициации такого импульса получило название доминирующего водителя ритма. Другие области, способные стать водителем ритма, но стимулируемые доминирующим водителем ритма, называются подчиненными, или латентными, водителями ритма.

Рис. 3.18. Основные механизмы, обусловливающие изменения частоты разрядов пейсмекерных волокон.
Верхняя диаграмма: снижение частоты, вызванное уменьшением наклона диастолической, или пейсмекерной, деполяризации (от а и б) и соответствующее увеличение времени, необходимого для изменения мембранного потенциала до порогового уровня (ПУ). Нижняя диаграмма: снижение частоты, связанное со сдвигом порога потенциала от ПУ-1 до ПУ-2 и соответствующее увеличение продолжительности цикла (от б до в); показано также дальнейшее снижение частоты вследствие повышения максимального уровня диастолического потенциала (сравните а—в с г—д) [3].
Собственная частота, с которой клетка-пейсмекер генерирует импульсы, определяется взаимодействием трех факторов: 1) уровнем максимального диастолического потенциала; 2) уровнем порога потенциала; 3) степенью наклона в фазу 4 деполяризации. Изменение любого из этих факторов влияет на время, затрачиваемое в фазу 4 на изменение мембранного потенциала от максимального диастолического уровня до порогового уровня потенциала (рис. 3.18); следовательно, оно влияет и на частоту возникновения импульса. Например, если максимальный диастолический потенциал возрастает (становится более отрицательным), спонтанная деполяризация до порогового потенциала осуществляется дольше и частота возникновения импульса снижается (см. рис. 3.18). И наоборот, с уменьшением максимального диастолического потенциала частота инициации импульса повышается. Аналогично этому, изменения порогового уровня потенциала или степени наклона во время фазы 4 деполяризации влияют на частоту возникновения импульсов. В здоровом сердце наиболее быстрая деполяризация до порога отмечается в клетках синусового узла; следовательно, собственный ритм синусового узла выше, чем в других клетках. Поэтому синусовый узел обычно является доминирующим водителем ритма.
Если активность синусового узла внезапно прекращается, латентный водитель ритма не сразу начинает генерировать импульсы: обычно они появляются лишь после продолжительного периода молчания. Частота инициации импульсов латентным водителем ритма вначале весьма невелика, но постепенно она повышается до определенного стабильного уровня, который, однако, ниже исходного уровня в синусовом узле [91].
Период молчания, следующий за прекращением синусового ритма, отражает утомление от ингибирующего влияния, оказываемого доминирующим водителем ритма на латентный водитель ритма. В здоровом сердце подобное торможение обычно обеспечивает синусовому узлу функционирование в качестве единственного водителя ритма; оно названо подавлением усиленной стимуляцией (overdrive suppression).
Такое подавление обусловлено более частой стимуляцией клетки-пейсмекера по сравнению с ее собственным спонтанным ритмом и опосредовано повышенной активностью Na—К-насоса. Так как ионы натрия входят в клетку во время каждого потенциала действия, с повышением частоты стимуляции увеличивается количество натрия, входящего в клетку за данное время. Частота активности натриевого насоса в значительной мере определяется внутриклеточной концентрацией натрия, так что при высокой частоте стимуляции активность насоса возрастает [92]. Как уже отмечалось, Na—К-насос обычно больше работает на выведение ионов Na+ из клетки, чем на введение в нее ионов К+, эффективно генерируя таким образом суммарный выходящий (гиперполяризующий) ток Na+. Когда частота стимуляции латентных клеток-пейсмекеров выше их собственного ритма, проходящий благодаря насосу гиперполяризующий ток дополнительно подавляет спонтанное возникновение импульсов в этих клетках. После прекращения активности под влиянием доминирующего водителя ритма такое угнетение латентных клеток-пейсмекеров ответственно за период молчания, продолжающийся до тех пор, пока концентрация Nа+ внутри клетки, а значит, и в токе, проходящем’благо даря насосу, не снизится настолько, чтобы латентные клетки-пейсмекеры смогли деполяризоваться до порогового уровня, обеспечив тем самым возникновение следующего импульса. Представляется вполне вероятным, что доминирующий водитель ритма контролирует другие потенциальные пейсмекеры с помощью механизма подав ления усиленной стимуляцией независимо от влияния нормального автоматизма или триггерной активности на пейсмекерность других клеток, ведь амплитуда постдеполяризации, при которой возникают триггерные импульсы, также должна снижаться с увеличением тока, проходящего благодаря насосу. Однако влияние доминирующего синусового водителя ритма на нормальный и аномальный (при низком мембранном потенциале) автоматизм может существенно различаться. Аномальный автоматизм (в отличие от нормального) не может подавляться усиленной стимуляцией [93]. Поэтому возникновение импульсов в латентных водителях ритма с аномальным автоматизмом может наблюдаться сразу же после внезапного прекращения активности синусового узла.
Механизмы смещения доминирующего водителя ритма
Смещение места возникновения импульсов (водителя ритма) за пределы синусового узла может быть обусловлено либо неспособностью импульсов к активизации сердца, либо усилением их инициации в латентном водителе ритма. Генерирование импульсов в синусовом узле может быть замедленным или даже подавленным в результате изменения активности вегетативной нервной системы [94] либо вследствие поражения синусового узла [95]. Снижение симпатической активности или повышение парасимпатической (вагусной) активности угнетает автоматизм синусового узла; заболевание синусового узла может привести к дегенерации его клеток. Возможен и другой вариант: проведение возбуждения из синусового узла в предсердия может быть ухудшено в какой-то части пути. При любом из указанных состояний может иметь место ускользание латентного водителя ритма.
Устранение сверхстимуляции в результате ослабления (или исчезновения) синусового ритма позволяет диастолической деполяризации латентного водителя ритма достичь порогового уровня и вызвать появление импульсов. Такой ускользающий ритм в норме наблюдается в АВ-соединении (АВ-узел или пучок Гиса), так как собственный ритм клеток этой области выше, чем в других эктопических зонах. Однако иногда патологический процесс, подавляющий инициацию импульсов в синусовом узле, угнетает ее и в АВ-соединении [95]; тогда место возникновения эктопических импульсов обычно находится на каком-либо другом участке проводящей системы предсердий или желудочков. Механизмом спонтанной диастолической деполяризации, предшествующей эктопическому ритму, может служить либо нормальный пейсмекерный ток, возникающий при высоком мембранном потенциале в нормальных волокнах Пуркинье, либо пейсмекерный ток, наблюдаемый при более низком мембранном потенциале в АВ-клапанах или АВ-узле.
Многие факторы способны повысить активность латентного водителя ритма и вызвать смещение места инициации возбуждения в эктопическую зону, даже если синусовый узел функционирует нормально. Например, норадреналин, высвобождаемый симпатическими нервными окончаниями, ускоряет спонтанную диастолическую деполяризацию большинства эктопических клеток-пейсмекеров, позволяя мембранному потенциалу этих клеток достигнуть порогового уровня, прежде чем они будут активированы импульсом, проведенным из синусового узла [96]. Норадреналин может выделяться локально в определенных очагах эктопической активности, вызывая тем самым смещение водителя ритма [97, 98]. Такой эффект катехоламинов может быть результатом его хорошо известного действия на нормальный пейсмекерный ток в волокнах Пуркинье [99] или же действия на пейсмекерные токи, возникающие при более низких мембранных потенциалах. Известно также, что норадреналин увеличивает амплитуду задержанной постдеполяризации в клетках митрального клапана и коронарного синуса [40, 41], и если постдеполяризация достигает порогового уровня, то триггерная активность может быть инициирована при частоте выше синусовой. Заболевания сердца также могут привести к возникновению активности латентного водителя ритма; так, снижение мембранного потенциала может обусловить появление автоматической активности в клетках предсердий и желудочков, а также в волокнах Пуркинье, как было описано ранее. Такой тип спонтанной активности часто наблюдается при частоте выше синусовой, а значит, место инициации возбуждения может при этом сместиться в пораженную область сердца. Как отмечалось выше, автоматическая активность, вызванная снижением мембранного потенциала, по-видимому, не угнетается усиленной стимуляцией, исходящей из синусового узла.
- Аномальный автоматизм и триггерная активность
- Постдеполяризации и триггерная (наведенная, пусковая) активность
- ИЗМЕНЕНИЯ АВТОМАТИЗМА СА УЗЛА (СИНУСОВЫЕ ТАХИКАРДИЯ, БРАДИКАРДИЯ, АРИТМИЯ)
- Атриовентрикулярная блокада, вызванная аритмией
- АРИТМИИ, СВЯЗАННЫЕ С ПРОЯВЛЕНИЕМ АКТИВНОСТИ ЛАТЕНТНЫХ ВОДИТЕЛЕЙ РИТМА (КРОМЕ ТАХИКАРДИИ)
- Триггерная вспомогательная вентиляция легких
- Адаптационная и триггерная вспомогательная вентиляция легких
- Активность эндонуклеаз гепатоцитов у больных с различной степенью активности вирусного гепатита.
- Анормальный автоматизм
- Нарушение функции автоматизма
- Автоматизм и диссоциация
- Физиологический (нормальный) автоматизм СА узла и латентных центров
- Биологически активные белки вируса гриппа. Активность транскриптазы в клетках и вирионах гриппа
- Повышенный автоматизм волокон за пределами центра синусового узла
- Изменения автоматизма синусового узла
- Нарушения ритма, связанные с медленными каналами: зависимость проведения и автоматизма
Источник
Что это такое
Аритмия – нарушение регулярности и последовательности сокращений сердца. Все, что не является синусовым ритмом, называется этим термином и включает в себя разнообразные патологии образования импульса и его проведения. Но из обывателей мало кто это знает, и считается, что если пациент сказал врачу: «У меня аритмия!», – то он все понял и сразу решит проблему, выписав одно определенное лекарство.
Увы, все не так просто.
Существует не одна классификация аритмий, но поскольку моя задача – познакомить читателей с разнообразием и помочь самостоятельно в нем разобраться, а не провести лекцию для кардиологов, то я разделю их на 2 группы:
- нарушение образования импульса – сюда мы отнесем экстрасистолии и тахикардии;
- патология проведения это же сигнала – блокады и брадиаритмии.
Как происходит нормальное сокращение сердца? В норме верховодит синусовый узел – электростанция, генерирующая импульсы и передающая их дальше через межузловые пути к атриовентрикулярному узлу, от которого сигнал идет по пучку Гиса, на его правую и левую ветвь, к волокнам Пуркинье и к миокарду желудочков.
Причины аритмий
Выделяют три группы причин:
- кардиальные – когда имеется сердечно-сосудистая патология: ишемическая болезнь, гипертония, порок сердца, миокардит, перикардит, кардиомиопатия и так далее;
- экстракардиальные – к ним относятся заболевания других органов и систем (хронический бронхит, патологии щитовидной железы, желудочно-кишечного тракта), прием лекарственных препаратов (антиаритмики, симпатомиметики, антидепрессанты, диуретики и др.) или токсическое воздействие (курение, алкоголь, наркотики), а также электролитные нарушения (гипо- или гиперкалиемия, гипомагниемия и т. д.);
- идиопатические – когда причину аритмии выявить не удалось.
Механизм возникновения нарушений сердечного ритма
Сердце обладает следующими способностями:
- автоматизм – кардиомиоциты могут спонтанно генерировать импульс (благодаря этому их называют «пейсмейкерами»);
- возбудимость – клетки воспринимают сигнал и реагируют на него;
- проводимость – импульс может распространяться по проводящей системе сердца;
- сократимость – способность сокращаться в ответ на раздражитель.
Таким образом, миокард самостоятельно генерирует электрические токи, которые проводятся по внутрисердечным путям, возбуждают мышцу и вызывают его сокращение.
Как было отмечено ранее, аритмии возникают вследствие нарушения образования импульса либо проведения. Основные механизмы представлены на рисунке ниже.
Изменение автоматизма в синусовом узле является причиной тахикардий, брадикардий (при слабости синусового узла) и других аритмий. Если повышается возбудимость нижележащих звеньев проводящей системы, например атриовентрикулярного соединения, то он берет на себя роль водителя ритма, и возникает эктопический ускоренный ритм.
Триггерная активность – это образование импульсов кардиомиоцитами, в норме не обладающими пейсмекерной (сигналообразующей) функцией. Этот механизм лежит в основе экстрасистолий и тахикардий так же, как и другой, re-entry (в его случае сигнал вызывает одно сокращение, но при определенных условиях он может возбуждать миокард неоднократно из-за циркуляции тока по кругу).
Блокада возникает, когда импульс сталкивается с тканью, неспособной прореагировать на сигнал, например с постинфарктным рубцом, занявшим место поврежденной проводящей системы сердца.
Признаки и симптомы: какие жалобы у пациентов
Палитра клинических проявлений разнообразна и красочна: от нормального самочувствия до потери сознания и аритмогенного шока.
В зависимости от вида аритмии, психоэмоционального статуса и сопутствующих заболеваний пациенты предъявляют следующие жалобы:
- замирание сердца;
- удары сердца о грудную клетку;
- учащенное сердцебиение;
- головокружение, потемнение в глазах;
- одышка, чувство нехватки воздуха;
- слабость, утомляемость;
- потеря сознания и так далее.
Эти симптомы сопровождаются чувством страха и не всегда являются специфичными. Подобную картину заболевания описывают также соматически (телесно) здоровые люди, страдающие паническими атаками, неврозами или фобиями. В этих ситуациях речь идет о психосоматике, и требуется работа с психотерапевтом, а не лечение у кардиолога.
Случай из практики: аритмия у женщины
В моей практике был интересный случай: обратилась женщина средних лет с жалобами на эпизоды потери сознания. Они происходили во время физической нагрузки (подъем по лестнице, езда на велосипеде), которая сопровождалась выраженной одышкой, и перед тем, как упасть, она ощущала сердцебиение. До обращения к кардиологу больная прошла обследование у невролога, но никаких отклонений не было выявлено.
При проведении эхокардиографии сердца визуализировано: вторичная гипертрофическая кардиомиопатия, развившаяся в результате субклапанного стеноза аорты. Утолщенный миокард левого желудочка – фактор риска развития жизнеопасных тахикардий и внезапной сердечной смерти. Во время суточного мониторирования ЭКГ были зафиксированы пробежки желудочковой аритмии различной продолжительности.
Пациентка направлена на оперативное лечение – коррекцию порока сердца и абляцию (прижигание) зоны аритмии.
Особенности у мужчин
Особенностью у нарушений ритма у мужчин является «синдром праздничного сердца». Это состояние, при котором после кратковременного употребления больших доз алкоголя (обычно во время застолий) возникает аритмия. Чаще случается фибрилляция предсердий (мерцалка) или желудочковые нарушения ритма.
Клинически данный синдром проявляется ощущением сердцебиения, чувством слабости, одышкой, дискомфортом в грудной клетке, которые могут привести к аритмогенной смерти. Механизмы влияния спиртного на сердце заключается как в прямом токсическом действии, так и в повышении активности симпатической нервной системы и электролитном дисбалансе. При хроническом алкоголизме развивается кардиомиопатия, основными проявлениями которой являются сердечная недостаточность и нарушения ритма сердца.
Если вовремя отказаться от употребления спиртного, есть шанс восстановить насосную функцию сердца, но где тот предел, когда еще не поздно, ученым выяснить не удалось. Отношение к выпивке в нашей стране очень легкомысленное, в народе считается, что алкоголь «чистит сосуды» и его употребление связано с пользой для здоровья. Да, у систематически выпивающих людей редко случаются инфаркты — они умирают от внезапных аритмий, не доживая до тромбоза.
Классификация аритмий
Поскольку статья общеобразовательная, не буду перегружать вас научными терминами, патофизиологией и прочими характеристиками, а в общих чертах объясню, на какие основные группы делятся аритмии.
По источнику (топографически) они бывают наджелудочковыми (все, что возникает выше атриовентрикулярного узла) и желудочковыми. По частоте ритма выделяют тахикардии (с ЧСС более 90-100 в минуту) и брадикардии (замедление ритма до 50-60 ударов и меньше). Тахикардии в свою очередь подразделяются на наджелудочковые и желудочковые, пароксизмальные и непароксизмальные.
В основе брадикардий лежит нарушение проводимости импульса – блокада, которая может быть синоатриальной, атриовентрикулярной, межпредсердной и внутрижелудочковой. Это наиболее часто встречаемые аритмии, и подобная классификация дает представление о том, как нужно их лечить.
Таблица 1. Классификация аритмий.
По локализации:
|
По частоте сердцебиений:
|
Тахикардии:
|
Блокады:
|
Отдельно выделю экстрасистолию – «королеву» среди аритмий. Подавляющее число пациентов обращаются ко мне именно с этой проблемой. Экстрасистолы – внеочередные сокращения сердца. Они встречаются у всех – как у здоровых, так и у лиц с различными заболеваниями – и нередко отнимают покой и сон у пациентов из-за тягостных ощущений, которые они испытывают во время перебоев ритма.
С этим типом нарушения ритма связан интересный парадокс: у здоровых лиц они не представляют опасности для жизни, несмотря на яркие проявления симптомов. У людей же с серьезными органическими заболеваниями экстрасистолы могут протекать бессимптомно и быть случайной находкой на электрокардиограмме или суточном мониторировании ЭКГ.
Проявления на кардиограмме
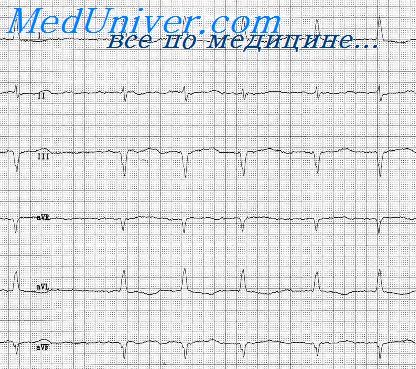
Рассмотрим признаки аритмии на электрокардиограмме на примере экстрасистолии, тахикардии и блокады проведения импульса.
Если у пациента есть экстрасистолия, например предсердная, его ЭКГ будет выглядеть следующим образом: на фоне синусового правильного ритма, где между желудочковыми комплексами одинаковые интервалы, появляется внеочередное сокращение, после которого следует пауза различной продолжительности в зависимости от вида экстрасистолы.
Тахикардию разберем на двух примерах: пароксизмальная АВ-узловая и желудочковая. При первом типе аритмии на ЭКГ зафиксирован эпизод ритма с высокой частотой, при этом она сохраняется постоянной на протяжении всего пароксизма. Комплексы на кардиограмме узкие и не будут видны зубцы Р, характерные для синусового ритма.
При желудочковой тахикардии регистрируются расширенные деформированные комплексы, напоминающие блокады ножек пучка Гиса, ЧСС – более 120 ударов в минуту.
В случае развития блокады, например АВ-блокады 1 степени, на ЭКГ мы видим удлинение интервала PQ более, чем на 0,2 сек, что отражает нарушение проведения импульса от предсердий к желудочкам. При АВ-блокаде 2 степени Мобитц 2 возникает внезапное выпадение комплекса, при этом интервал PQ либо удлиненный, либо нормальный.
Лечение нарушений сердечного ритма
«Есть аритмия – должен быть назначен антиаритмик» – логически рассуждает каждый, но это не так.
Аритмия может быть СИМПТОМОМ болезни и не обязательной сердечной! Тиреотоксикоз – состояние, обусловленное избыточным синтезом тиреоидных гормонов. Он осложняется фибрилляцией предсердий, и именно мерцательная аритмия является первым признаком нарушения функции щитовидной железы.
У женщин при климаксе возникают экстрасистолы, и они не требуют лечения антиаритмиками, так как причина устранима другим путем – назначением гормональных препаратов.
У больных с ишемической болезнью сердца одним из симптомов патологии считаются различные нарушения ритма – от экстрасистолии до желудочковой тахикардии – и первый пункт в их лечении – это устранение ишемии миокарда путем операции: стентирование коронарных артерий либо аорто-коронарное шунтирование.
У пациентов с перенесенным инфарктом миокарда субстратом аритмии является участок на границе рубца и здоровой ткани сердца. Этим людям рекомендуется абляция очага нарушения ритма либо гомогенизация этой области.
Большую группу пациентов составляют люди с мерцательной аритмией – нарушением возбудимости, при котором в предсердном миокарде возникают множественные импульсы, вызывающие сокращения мышцы несинхронно с работой желудочков. Помимо антиаритмических препаратов таким людям показаны антикоагулянты и терапия основного заболевания (например, ингибиторы АПФ при артериальной гипертензии), а также хирургическую деструкцию аритмогенных зон.
Пароксизм тахикардии (желудочковой, мерцательной аритмии, ортодромной с участием ДПП и т. д.) может осложниться аритмогенным шоком с падением артериального давления и отсутствием периферического пульса (на руке). Методом выбора в данной ситуации является экстренная электроимпульсная терапия с помощью дефибриллятора. Электрический разряд прерывает волну ре-ентри и восстанавливается синусовый ритм.
Антиаритмические препараты систематизированы в 4 группы и назначаются только врачом. Несмотря на то, что они созданы для лечения нарушений ритма, эти лекарства могут приводить к возникновению аритмий, поэтому применение требует осторожности и контроля кардиолога. Антиаритмики 1 класса противопоказаны пациентам с перенесенным инфарктом миокарда, хронической сердечной недостаточностью и гипертрофией левого желудочка более 14 мм.
Что касается блокад, то тактика их ведения зависит от уровня поражения и степени. АВ-блокада 3 степени, остановки синусового узла с асистолией желудочков являются абсолютными показаниями к имплантации постоянного кардиостимулятора. АВ-блокада высокой степени может сопутствовать инфаркту миокарда нижней стенки левого желудочка. Ранняя реваскуляризация приводит к восстановлению работы атриовентрикулярного узла.
Советы врача: как избавиться от аритмии
Золотое правило «легче предупредить, чем лечить» остается актуальным и в случае с аритмией. Занятия физическими упражнениями, здоровое сбалансированное питание, контроль артериального давления и отказ от вредных привычек всегда стоят во главе угла. Профилактика – наше все!
Неправильный ритм жизни, короткий сон, злоупотребление алкоголем, кофеинсодержащими напитками, психостимуляторами, стресс тоже вредят здоровью и могут провоцировать нарушения ритма и проводимости, поэтому нормализация режима труда и отдыха – далеко не последний компонент терапии аритмий. Пациентам с неврозами необходимо дать рекомендацию обратиться за помощью к психотерапевту.
Прежде чем лечить аритмию, нужно выяснить ее этиологию. Бессмысленно устранять симптом, если мы не знаем первопричину. У меня на приеме была молодая беременная женщина с жалобами на учащенное сердцебиение. У нее отсутствовали заболевания сердечно-сосудистой системы, и для уточнения диагноза я назначила ей общий анализ крови и сывороточное железо.
В итоге диагностирована железодефицитная анемия с гемоглобином 80 мг/л, которая и послужила причиной тахикардии у женщины. Назначение этиотропной терапии – препарата железа – купировало через некоторое время все симптомы. Бета-блокаторы для урежения пульса не решили бы проблему, а только усугубили ее.
В чем опасность и каковы прогнозы
Для определения прогноза пациента используется классификация, созданная Дж. Биггером. В зависимости от типа аритмии, наличия кардиоваскулярного заболевания оценивается риск внезапной сердечной смерти, и исходя из этого нарушение ритма считается доброкачественным или злокачественным. Чем серьезнее и опаснее проблема, тем интенсивнее ее необходимо устранять, а у пациентов с предсердной экстрасистолией и без патологии сердца аритмию искусственно убирать не стоит.
В процессе лечения оценивается возможный риск и польза от приема антиаритмических препаратов. Если есть риск развития нежелательных последствий (проаритмогенный эффект в первую очередь), то назначение нерационально и опасно.
Помимо терапии аритмии, обязательный пункт – лечение заболевания, последствием которого она стала. Частой причиной фибрилляции предсердий служит артериальная гипертония, и без контроля систолического и диастолического давления изменения в сердце продолжают развиваться, а пароксизмы мерцательной аритмии возникают чаще. Также при усугублении хронической обструктивной болезни легких, бронхиальной астмы наблюдается формирование легочного сердца и ухудшение течения аритмии.
Проведение катетерной абляции (модификации АВ-узла при пароксизмальной АВ-узловой тахикардии) в малом проценте случаев осложняется развитием полной поперечной блокады с дальнейшей необходимостью имплантации электрокардиостимулятора. Также операция может усугубиться гемоперикардом, перфорацией камер сердца, но это весьма редкие ситуации. Абляция остается главным способом устранить пароксизмальную тахикардию раз и навсегда.
У пациентов с синдромом WPW и редкими, малосимптомными приступами возможно динамическое наблюдение у врача. При этом существуют не медицинские, а социальные показания к разрушению ДПП (той же абляции). Данный пункт касается летчиков, космонавтов, профессиональных спортсменов и др. Если же пароксизмы протекают с выраженной симптоматикой, нарушающей повседневную жизнедеятельность, то катетерная деструкция является вариантом выбора в любом случае.
Источник